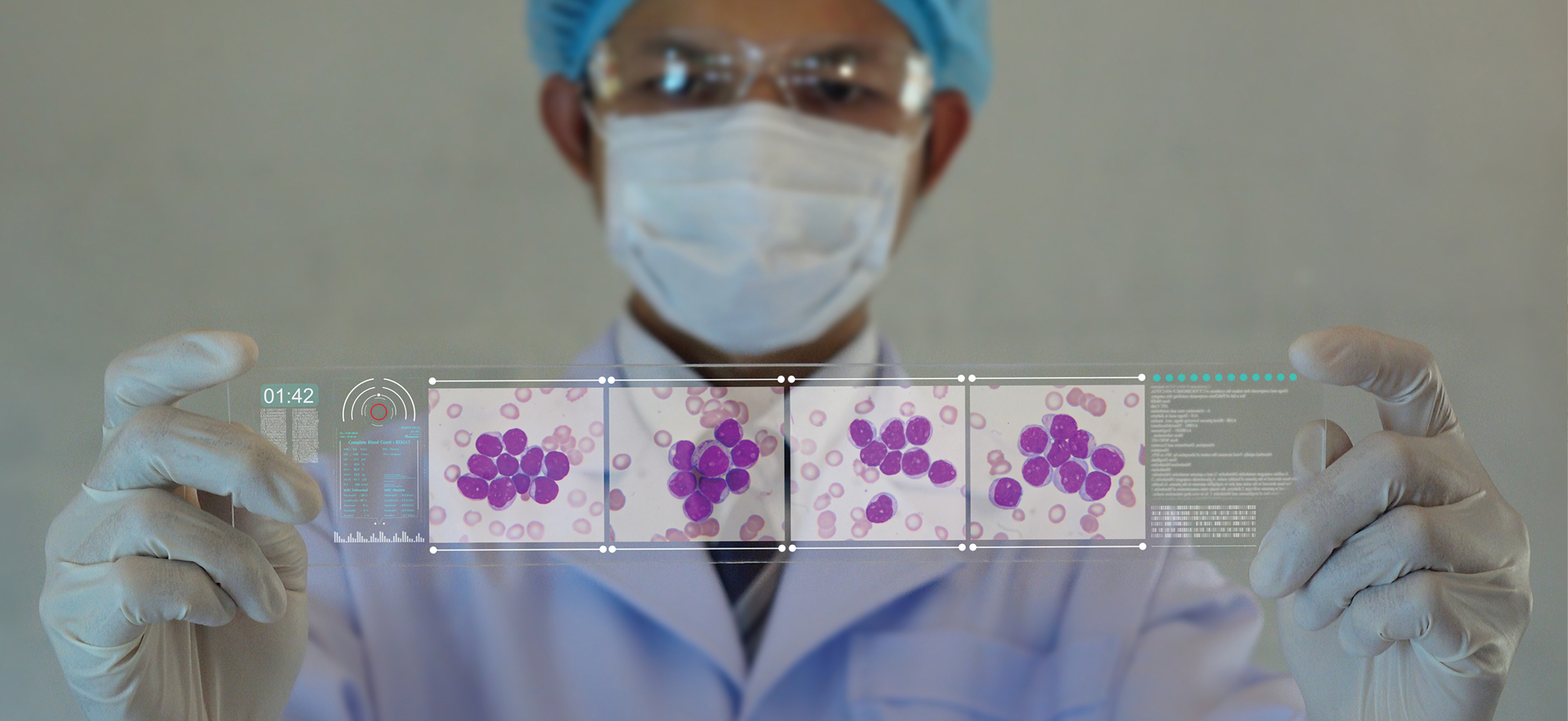
Leucemia: l’essenziale per i medici di medicina generale
di Dr.ssa Joanne T. C. Gbenjo, Dr.ssa Georgia L. M. McCrary, Dr.ssa Sarah E. Wilson, • Settembre 2023
La leucemia è causata da una proliferazione anomala delle cellule staminali ematopoietiche del midollo osseo. I quattro sottotipi principali sono la leucemia linfoblastica acuta, la leucemia mieloide acuta, la leucemia linfatica cronica e la leucemia mieloide cronica. La leucemia linfoblastica acuta si manifesta principalmente nei bambini, mentre gli altri sottotipi sono più comuni negli adulti. I fattori di rischio includono l’esposizione a sostanze chimiche e a radiazioni ionizzanti ed alcune condizioni genetiche. I sintomi comuni includono febbre, astenia, calo ponderale, dolori articolari e la comparsa di ematomi o sanguinamenti. La diagnosi viene confermata dalla biopsia del midollo osseo o dallo striscio di sangue periferico. I pazienti con sospetta leucemia devono essere valutati da uno specialista ematologo-oncologo. La chemioterapia, la radioterapia, la terapia molecolare mirata, gli anticorpi monoclonali ed il trapianto di cellule staminali ematopoietiche rappresentano i principali trattamenti. Le complicanze del trattamento includono gravi infezioni dovute all’immunosoppressione, la sindrome da lisi tumorale, eventi cardiovascolari ed epatotossicità. Tra le sequele a lungo termine nei sopravvissuti vi sono i tumori maligni secondari, le malattie cardiovascolari ed i disturbi muscoloscheletrici ed endocrini. I tassi di sopravvivenza a cinque anni sono maggiori nei pazienti più giovani e in quelli con diagnosi di leucemia mieloide cronica o linfatica cronica.
(Am Fam Physician. 2023; 107(4): 397-405. Copyright © 2023 American Academy of Family Physicians.)
(Am Fam Physician. 2023; 107(4): 397-405. Copyright © 2023 American Academy of Family Physicians.)
Articoli correlati
Emergenze ematologiche: identificazione e trattamento
di
Dr. Darrell Edward Jones, dr.ssa Jennifer J. Walker, dr. Alain Michael P. Abellada
Aprile 2025
In evidenza
di
Claire Elizabeth Powers Smith, Vinayak Prasad
∙
Aprile 2021
di
Aaron Saguil, Matthew V. Fargo
∙
Febbraio 2021
Nuove Evidenze
di
Dr. Shelley S. Selph, Dr. Marian S. McDonagh
∙
Novembre 2020